背景
免疫检测点抑制剂类药物治疗是非小细胞肺癌(NSCLC)的有效治疗方法之一,中国NMPA及美国FDA已批准免疫检测点抑制剂类药物作为NSCLC的一线或二线治疗方案。抗PD-1和抗PD-L1免疫疗法已经展现出一定的临床疗效,但相关的伴随诊断仍有较大研究空间。
PD-L1是一种动态的生物标志物,由于PD-L1的表达是动态的,受空间(原发灶或转移灶)和时间(活检和后续治疗之间的间隔)的影响,其表达水平可能会发生变化,而传统组织活检只能检测肿瘤组织局部区域,不能反应肿瘤整体状态及其动态变化,液体活检作为一种非侵入性的新型检测技术,可动态且无创反映肿瘤的全貌。
PD-L1的表达可在循环肿瘤细胞(CTC)上进行检测,这种检测方法在非小细胞肺癌研究中已有报道,但其与组织表达PD-L1的一致性以及其对免疫检测点抑制剂类药物治疗反应的相关性仍需要进一步研究。
研究方法
对计划接受纳武单抗治疗的晚期转移性NSCLC患者,采集用药前和治疗过程中的血样。通过免疫荧光法评估CTC的PD-L1表达,组织活检样本通过免疫组化法评估PD-L1表达。
研究结果
1、入组接受纳武单抗治疗前及疾病发生进展时的晚期转移性NSCLC患者96名,共113份样本,进行组织和循环肿瘤细胞(CTC) PD-L1表达的检测。结果表明,PD-L1表达在CTC中的阳性率通常高于肿瘤组织(83% vs 41%),不存在明显的相关性(r=0.04, P=0.77).
PD-L1表达检测在组织和CTC之间的一致性为45.4%(30/66);在不一致的36例病例中,31例患者的PD-L1表达检测在组织上呈阴性但在CTC上呈阳性,5例在组织上呈阳性但在CTC上未呈阳性(图1C)。在30例一致的病例中,8例均为阴性,22例均为阳性。
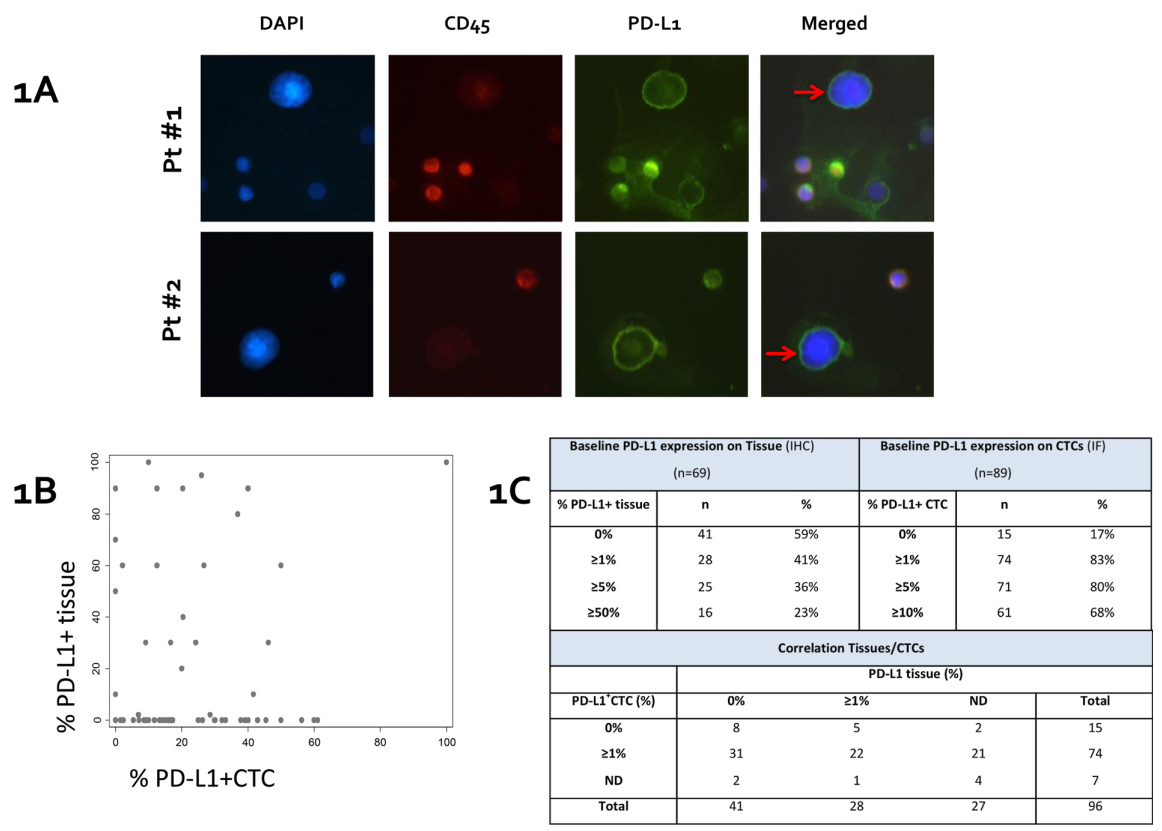
图1:CTC计数与PD-L1表达分析
2、该研究患者群体在接受免疫检测点抑制剂药物后的生存分析证明了患者CTC计数检测的预后价值。
共89位患者样本中可检测到CTC(n=89/96)。用药前CTC数量的中位数为30个/7.5ml,以该值作为临界值,与CTC计数低于30的患者相比,CTC计数高于30的患者(n=43/89)治疗结果更差(图2A和2B),有治疗反应的患者CTC数量更低(图2E)。
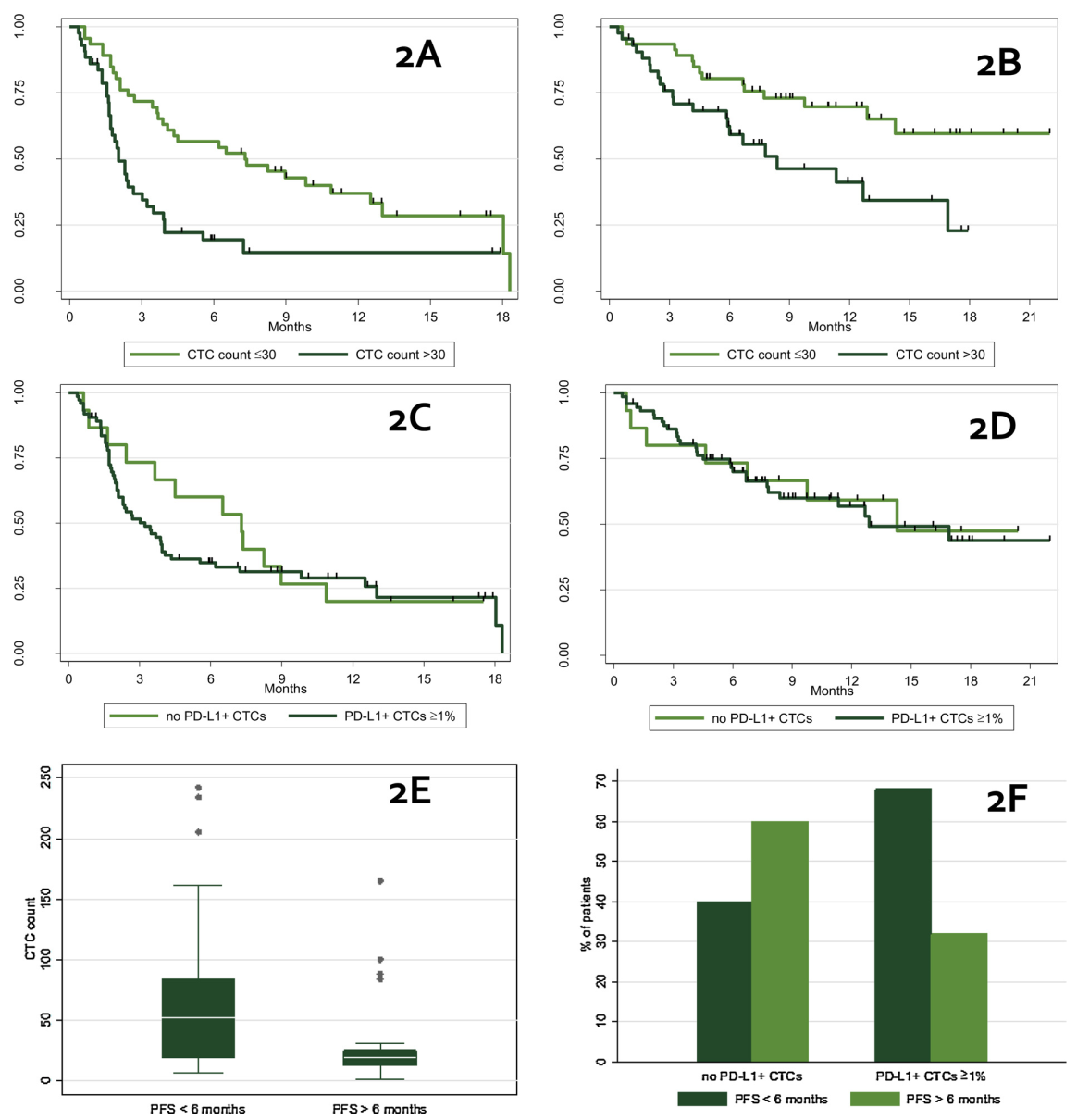
图2.治疗后患者生存分析
3、治疗前CTC PD-L1阳性对患者的无进展生存期(PFS)和总生存期(OS)没有显著影响(图2C和2D),然而,与治疗前CTC PD-L1阴性的患者相比,阳性患者对治疗无反应的频率更高(68% vs 40%)。所有进展期患者均检测到CTC PD-L1阳性,说明CTC PD-L1阳性的患者出现耐药的可能性更高(图2F)。
结论
1. PD-L1表达在CTC中的阳性率通常高于肿瘤组织(83% vs 41%);
2. 患者的CTC负荷数与患者预后存在相关性;
3.进展期CTC PD-L1阳性与患者耐药存在一定相关性。
参考文献
[1] Guibert N , Delaunay M , Lusque A , et al. PD-L1 expression in circulating tumor cells of advanced non-small cell lung cancer patients treated with nivolumab[J]. Lung Cancer, 2018, 120:108-112.