循环肿瘤细胞(Circulating Tumour Cells, CTCs)的发现可追溯到1869年, Ashworth发现血液中的一种血细胞同尸检发现的肿瘤细胞相似,这是CTC最早的观察和记录。CTC是指自发或因诊疗操作由实体瘤或转移灶释放进入外周血循环的肿瘤细胞, 是恶性肿瘤患者出现术后复发和远处转移的重要原因,也是导致肿瘤患者死亡的重要因素。
由于血液中CTC的含量极低,目前主流的检测方法是先捕获(富集)后检测,少量方法是直接检测。人体血液循环系统中CTC的含量极低,肿瘤转移患者每毫升全血中仅有1~10个CTC,因此要实现CTC的检测对其进行分选富集是一个关键的步骤。高灵敏性、快速、高细胞活性的CTC分选富集是CTC临床应用的重点和难点。本文就CTC捕获富集方法逐一介绍。
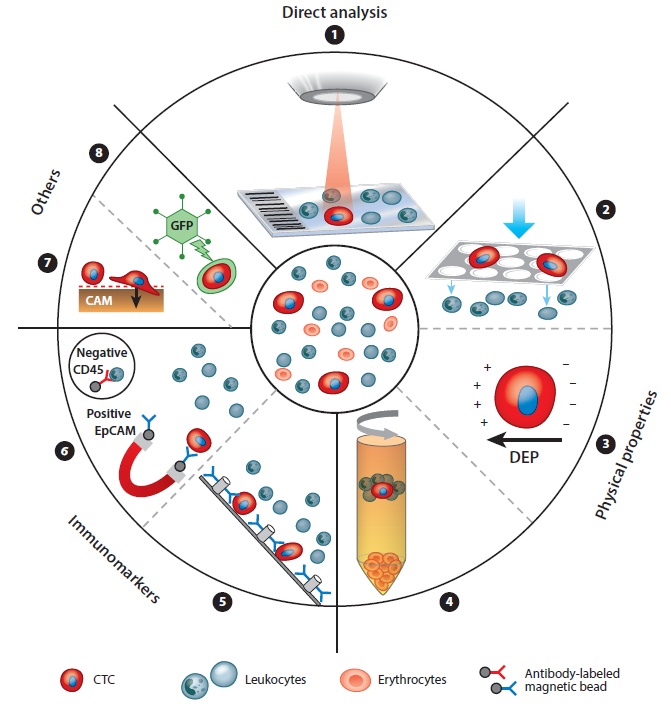
CTC的富集方法可以分为生物学特性(例如抗体)富集法和物理特性富集法。前者根据通过细胞表面特异性表达的蛋白质生物标志物分离靶细胞,包括正向捕获CTC和负向去除白细胞的阴性富集法。而物理富集法主要是根据CTC的大小、密度、力学和介电性能等物理特性将CTC分离出来。
一、物理富集法
物理富集法根据CTC的物理性质来分离,包括大小、密度、力学等性质。CTC的直径约为10-20μm,而血细胞大小为7-12μm,通过过滤可留下体积较大的CTC。从密度上来看,CTC的密度较白细胞和红细胞密度小,通过密度梯度离心可实现CTC分离。除了大小和密度的差异,有些技术也利用CTC和血细胞之间的力学和介电性质差异来捕获CTC。具体来说,CTC的可变形性不及血细胞。
微流控技术也在物理特性富集法中也有所应用。微流控芯片根据CTC与血细胞物理特性的差异,通过在芯片中设置不同的微结构单元将其从血液中分离出来,常用的微结构包括微孔、微过滤网和微柱等。
二、抗体富集法,分为阳性富集法和阴性富集法
其中阳性富集法主要利用特异性抗体与肿瘤细胞表面抗原进行特异性结合来富集CTC。CTC分为上皮细胞表型、间质细胞表型和上皮间质细胞混合表型,识别上皮标志物、识别间质标志物和识别上皮间质标志物。上皮标志物在正常上皮细胞和上皮肿瘤上表达,在间质白细胞上不存在,可区分癌细胞和正常血细胞。上皮细胞粘附分子(EpCMA)是最常用于上皮表型CTC阳性富集的细胞表面标志物。细胞角蛋白家族成员(即CK8,CK18和CK19)也是检测具有上皮表型癌症患者CTC的“金标准”。
阴性富集法也就是白细胞去除法,通常用识别CD45或CD14的特异性抗体与白细胞结合,去除全血中的白细胞的方案。
抗体捕获技术常用到具体检测技术有磁珠和微流控技术。免疫磁珠技术是根据免疫亲和的原理,将免疫磁珠与捕获抗体或特异性多肽(可与血液中的CTC或白细胞表面抗原相结合)相连接,随后通过磁场即可将磁珠捕获与未捕获的细胞分离。
三、生化和物理特性相结合的方法
将CTC的物理和生物化学特性结合起来用于CTC富集的方法有芯片法,基于CTC大小和表面标志物的表达情况进行CTC富集。该技术首先根据细胞大小,将较小的红细胞和血小板过滤出去,留下白细胞和肿瘤细胞。然后,用识别EpCAM的磁珠偶联抗体对CTC进行免疫染色,在磁场中捕获并收集在芯片上。
其中常用的是微流控技术,是一种精确控制和操控微尺度流体,广泛应用于CTC的分选富集中。微流体芯片技术基于亲和性富集法分离CTC时,芯片内部的微通道或微结构上修饰能够与CTC或白细胞表面抗原结合的特异性抗体或适配体,当血液流经芯片时,特异性抗体或适配体可与目的细胞表面抗原结合,随后将CTC或白细胞粘附在芯片上,实现CTC的阳性捕获或阴性富集。
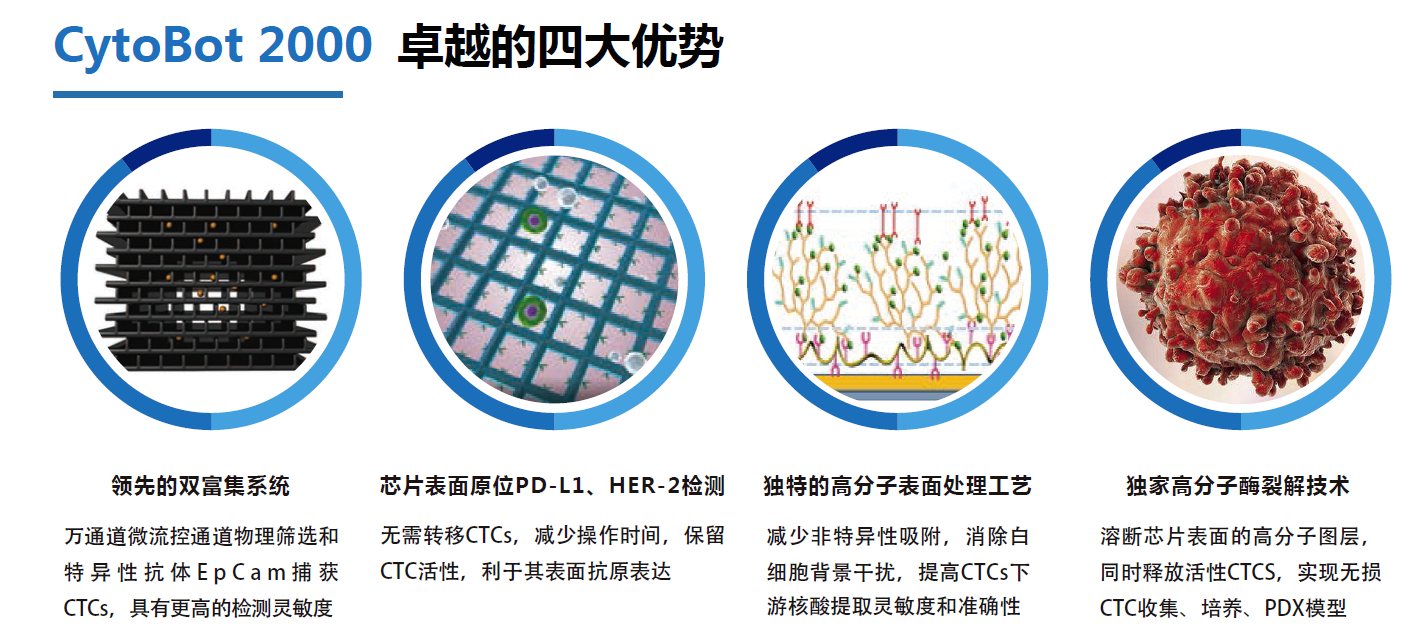
汇先医药基于英国剑桥大学微流控技术平台,首次将物理筛选和免疫特异性筛选结合,研发出了立体万道多层微流控特异性筛选芯片(CytoBot2000),在立体多层微流控芯片上结合了高特异性的多种抗体,识别并分离外周血中CTC。独家高分子酶裂解,溶断高分子释放活性循环肿瘤细胞,确保开展下游细胞培养、NGS检测。此外,CytoBot2000可原位检测PD-L1表达,为小细胞肺癌患者提供更多临床诊疗依据,特别是晚期异质性较强的患者,提高患者临床获益。
参考文献
NatRev Cancer. 2014 Sep;14(9):623-3
Curr Pharm Des . 2017;23(32):4726-4728. doi: 10.2174/1381612823666170616082608.
Cancer J . Mar/Apr 2018;24(2):70-77. doi: 10.1097/PPO.0000000000000310.